Travessa Cobre (Portuguesa [Parque Royal]) - CEP: 21932-866
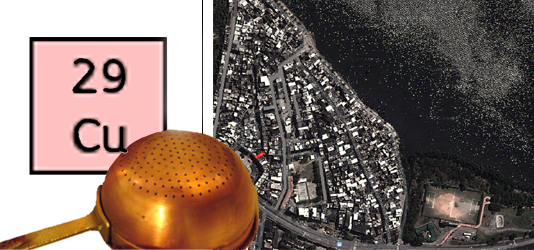
O cobre é um elemento químico de símbolo Cu (do latim cuprum), número atômico 29 (29 prótons e 29 elétrons) e de massa atômica 63,6 u. À temperatura ambiente o cobre encontra-se no estado sólido.
Classificado como metal de transição, pertence ao grupo 11 (1B) da Classificação Periódica dos Elementos. É um dos metais mais importantes industrialmente, de coloração avermelhada, dúctil, maleável e bom condutor de eletricidade.
Conhecido desde a pré-história, o cobre é utilizado atualmente, para a produção de materiais condutores de eletricidade (fios e cabos), e em ligas metálicas como latão e bronze.
O cobre foi provavelmente o primeiro metal minerado e trabalhado pelo homem. Foi originalmente obtido como um mineiral nativo e posteriormente da fundição de minérios. Estimativas iniciais da descoberta do cobre sugerem por volta de 9.000 a.C. no Oriente Médio. Foi o mais importante dos materiais da humanidade durante a Era do Cobre e Bronze. Objetos de cobre de 6.000 a.C. foram encontrados em Çatal Höyük, Anatolia. Em 5.000 a.C. já se realizava a fusão e refinação do cobre a partir de óxidos como a malaquita e azurita. Os primeiros indícios de utilização do ouro não foram vislumbrados até 4.000 a.C. Descobriram-se moedas, armas, utensílios domésticos sumérios de cobre e bronze de 3.000 a.C., assim como egípcios da mesma época, inclusive tubos de cobre. Os egípcios também descobriram que a adição de pequenas quantidades de estanho facilitava a fusão do metal e aperfeiçoaram os métodos de obtenção do bronze; ao observarem a durabilidade do material representaram o cobre com o Ankh, símbolo da vida eterna.
Na antiga China o uso do cobre é conhecido desde, pelo menos, 2.000 anos antes da nossa era, e em 1200 a.C. já fabricavam-se bronzes de excelente qualidade estabelecendo um manifesto domínio na metalurgia sem comparação com a do Ocidente.
O cobre é um metal de transição avermelhado, que apresenta alta condutibilidade elétrica e térmica, só superada pela da prata.
Na natureza são encontrados dois isótopos estáveis: Cu-63 e Cu-65, sendo o mais leve o mais abundante (69,17%). Se tem caracterizado 25 isótopos radioativos, sendo os mais estáveis o Cu-67, Cu-64 e Cu-61 com vidas médias de 61,83 horas, 12,7 horas e 3,333 horas respectivamente. Os demais radioisótopos, com massas atômicas desde 54,966 (Cu-55) a 78,955 (Cu-79), têm vidas médias inferiores a 23,7 minutos, e a maioria não alcançam os 30 segundos. O cobre apresenta, ainda, 2 estados metaestáveis.
Os isótopos mais leves que o Cu-63 estável se desintegram principalmente por captura eletrônica originando isótopos de níquel, os mais pesados que o isótopo Cu-65 estável se desintegram por emissão beta dando lugar a isótopos de zinco. O isótopo Cu-64 se desintegra dos dois modos, por captura eletrônica (69%) e os demais por desintegração beta.
O cobre ocupa a mesma família na tabela periódica que a prata e o ouro. Em termos de estrutura eletrônica, o cobre tem um elétron orbital em cima de uma cheia escudo do elétron, que faz ligações metálicas
O cobre tem um tom avermelhado, alaranjado ou cor acastanhada devido a uma fina camada de manchas (incluindo óxidos).
Fonte: Decreto nº 26.229, de 17 de fevereiro de 2006 (http://cm-rio-de-janeiro.jusbrasil.com.br) e Wikipedia
Tabela periódica: Wikipedia
Foto: panela de cobre (Sxc.Hu)
O cobre é um elemento químico de símbolo Cu (do latim cuprum), número atômico 29 (29 prótons e 29 elétrons) e de massa atômica 63,6 u. À temperatura ambiente o cobre encontra-se no estado sólido.
Classificado como metal de transição, pertence ao grupo 11 (1B) da Classificação Periódica dos Elementos. É um dos metais mais importantes industrialmente, de coloração avermelhada, dúctil, maleável e bom condutor de eletricidade.
Conhecido desde a pré-história, o cobre é utilizado atualmente, para a produção de materiais condutores de eletricidade (fios e cabos), e em ligas metálicas como latão e bronze.
O cobre foi provavelmente o primeiro metal minerado e trabalhado pelo homem. Foi originalmente obtido como um mineiral nativo e posteriormente da fundição de minérios. Estimativas iniciais da descoberta do cobre sugerem por volta de 9.000 a.C. no Oriente Médio. Foi o mais importante dos materiais da humanidade durante a Era do Cobre e Bronze. Objetos de cobre de 6.000 a.C. foram encontrados em Çatal Höyük, Anatolia. Em 5.000 a.C. já se realizava a fusão e refinação do cobre a partir de óxidos como a malaquita e azurita. Os primeiros indícios de utilização do ouro não foram vislumbrados até 4.000 a.C. Descobriram-se moedas, armas, utensílios domésticos sumérios de cobre e bronze de 3.000 a.C., assim como egípcios da mesma época, inclusive tubos de cobre. Os egípcios também descobriram que a adição de pequenas quantidades de estanho facilitava a fusão do metal e aperfeiçoaram os métodos de obtenção do bronze; ao observarem a durabilidade do material representaram o cobre com o Ankh, símbolo da vida eterna.
Na antiga China o uso do cobre é conhecido desde, pelo menos, 2.000 anos antes da nossa era, e em 1200 a.C. já fabricavam-se bronzes de excelente qualidade estabelecendo um manifesto domínio na metalurgia sem comparação com a do Ocidente.
O cobre é um metal de transição avermelhado, que apresenta alta condutibilidade elétrica e térmica, só superada pela da prata.
Na natureza são encontrados dois isótopos estáveis: Cu-63 e Cu-65, sendo o mais leve o mais abundante (69,17%). Se tem caracterizado 25 isótopos radioativos, sendo os mais estáveis o Cu-67, Cu-64 e Cu-61 com vidas médias de 61,83 horas, 12,7 horas e 3,333 horas respectivamente. Os demais radioisótopos, com massas atômicas desde 54,966 (Cu-55) a 78,955 (Cu-79), têm vidas médias inferiores a 23,7 minutos, e a maioria não alcançam os 30 segundos. O cobre apresenta, ainda, 2 estados metaestáveis.
Os isótopos mais leves que o Cu-63 estável se desintegram principalmente por captura eletrônica originando isótopos de níquel, os mais pesados que o isótopo Cu-65 estável se desintegram por emissão beta dando lugar a isótopos de zinco. O isótopo Cu-64 se desintegra dos dois modos, por captura eletrônica (69%) e os demais por desintegração beta.
O cobre ocupa a mesma família na tabela periódica que a prata e o ouro. Em termos de estrutura eletrônica, o cobre tem um elétron orbital em cima de uma cheia escudo do elétron, que faz ligações metálicas
O cobre tem um tom avermelhado, alaranjado ou cor acastanhada devido a uma fina camada de manchas (incluindo óxidos).
Fonte: Decreto nº 26.229, de 17 de fevereiro de 2006 (http://cm-rio-de-janeiro.jusbrasil.com.br) e Wikipedia
Tabela periódica: Wikipedia
Foto: panela de cobre (Sxc.Hu)